と疑問をお持ちの方の悩みを解決できる記事になっています。
加齢黄斑変性症(AMD)の定義
加齢黄斑変性症(AMD:age-related macular degeneration)は50歳以上で中心窩を中心に半径3000μmの範囲に認める加齢性の黄斑異常と定義され、滲出型と萎縮型に大別される。さらに、滲出型は下記のように大きく3つに大別される。
滲出型AMD
- 脈絡膜新生血管(CNV:choroidal neovascularization)に基づく病変
- CNVを伴わない1乳頭径以上の網膜色素上皮剥離(PED:pigment epithelial detachment)
- 特殊型:
・ポリープ状脈絡膜血管症(PCV:polypoidal choroidal vasculopathy)
・網膜血管腫状増殖(RAP: retinal angiomatous proliferation)
※日本において滲出型の半分以上がPCV、RAPは1~2%と言われている
加齢黄斑変性症(AMD)の疫学
加齢黄斑変性症(AMD)は主要先進国において失明原因の第1位で、日本でも第4位(70歳以上の高齢者で限定すると第1位)である。日本国内では1998年に福岡県久山町、2000~2002年に山梨県舟形町、2008~10年に滋賀県長浜市において調査がなされ、日本人のAMDの頻度およびリスクが明らかになりつつある。50歳以上の男女(男:女=3:1)の片眼性または両眼性(40%)に認める。
1.Hisayama Study
福岡市久山町の住民を対象に1961年から調査が開始され、1998年に眼底検査が行われている。加齢黄斑変性症の罹患率調査は50歳以上の1844人のうち、両眼検査を行った1486人を対象として実施された。
全体的に有病者数が少ないため、詳細な検討は制限されているものの、early AMDおよびドルーゼンは年齢とともにその有病率が増加した。男女別ではlate AMDおよび網膜色素上皮色素(RPE)異常が男性に多く、ドルーゼンの有病率に性差はなかった。ただ、追加調査でドルーゼンは女性に多く発症したと報告された。また、喫煙および白血球数がlate AMD発症に関係していた。
内訳(1998年)
- Early AMD(ドルーゼンおよびRPE色素異常)12.7%
- Late AMD(滲出型AMD or 萎縮型AMD)0.87%
- ドルーゼンあり9.6%
内訳(2003年)
新規で
- Early AMD(ドルーゼンおよびRPE色素異常)8.5%
- Late AMD(滲出型AMD or 萎縮型AMD)0.8%
内訳(2007年)
- Early AMD(ドルーゼンおよびRPE色素異常)10.0%
- Late AMD(滲出型AMD or 萎縮型AMD)1.4%
内訳(2012年)
- Late AMD(滲出型AMD or 萎縮型AMD)1.6%
ドルーゼンとは
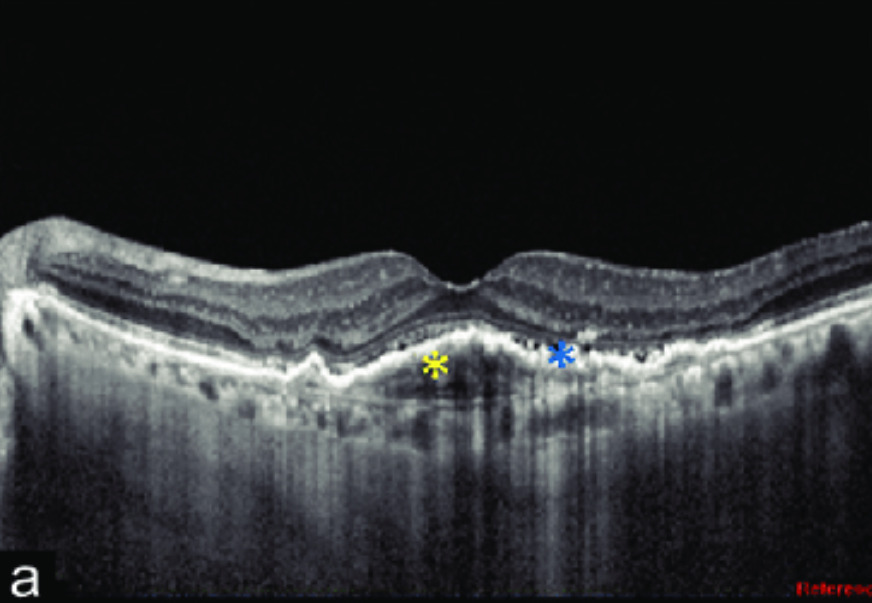
ドルーゼンは網膜色素上皮下(正確にはRPE細胞の基底膜とBruch膜の間)の黄白色小円形隆起病巣で、多形成物質(変性した蛋白、脂質)で構成されている。親水性と疎水性成分からなり、中心部の核と周辺部では構成成分が異なる。このドルーゼンが黄斑部にあれば加齢黄斑変性症の前駆病変となりうる。
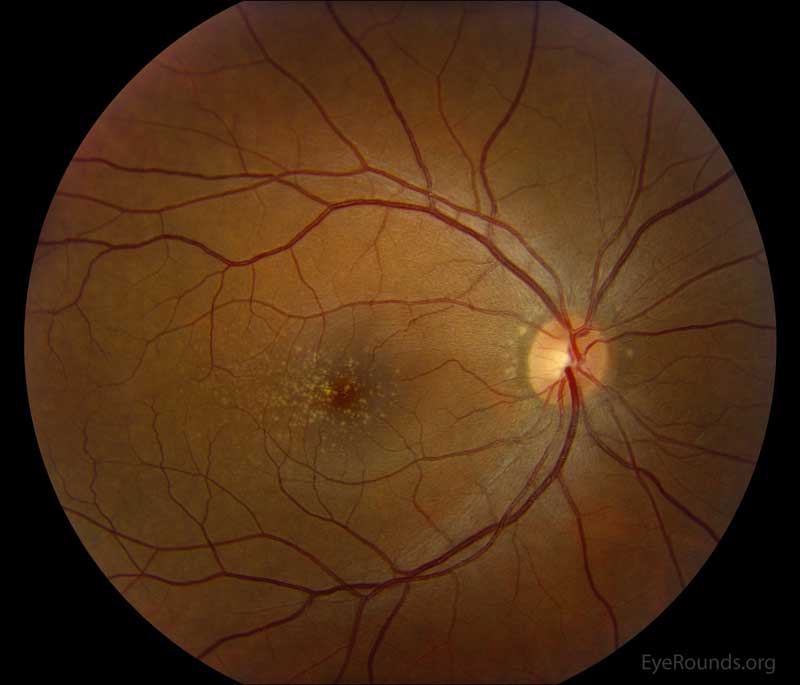
1.硬性ドルーゼン
直径63μm以下のドルーゼンを硬性ドルーゼンという。これのみでは病的意義は少ないとされる。蛍光眼底造影検査(FA)では硬性ドルーゼン上のRPEは進展されメラニン色素が少なくなるため、window defectにより初期から点状過蛍光となる。色素漏出はない。インドシアニングリーン蛍光造影(IA)では早期より過蛍光、後期までそれが持続する。
2.軟性ドルーゼン
直径63μm以上のドルーゼンは軟性ドルーゼンとされる。軟性ドルーゼンが1個以上あれば前駆病変と診断される。多くは250μm程度の大きさで、境界比較的不明瞭な病変としてみられる。直径125μm以上のドルーゼンはlarge drusen、それらが癒合したものをconfluent drusenという。
癒合が進み漿液性PEDに類似したものをdrusenoid PEDという。FAは早期でやや低蛍光、後期にわずかに過蛍光となる。IAは早期より低蛍光で、後期にはより低蛍光が明瞭となる。
2.Funagata Study
山形県舟形町の住民を対象に1990年から調査が開始され、加齢黄斑変性症の罹患率調査は2000~02年に行われている。35歳以上の1961人のうち、判定可能な右目の写真が得られた1625人を対象として実施された。
全体的に有病者数が少ないため、詳細な検討は制限されているものの、AMDおよびドルーゼンは年齢とともにその有病率が増加した。男女別ではDistinct drusenおよびLarge drusen、RPE色素異常が男性に多く、early AMD、late AMDの有病率に性差はなかった。その他の危険因子に関しては、喫煙がlate AMDに発症に関係すると報告されている。
内訳
- Early AMD(ドルーゼンおよびRPE色素異常) 3.5%
- Late AMD(滲出型AMD or 萎縮型AMD) 0.5%
- ドルーゼン+
Distinct drusen 15.1%
Indistinct drusen 1.7%
Large drusen 15.6%
3.Nagahama Study
滋賀県の北東部に位置する長浜市の住民を対象として2008年から開始された調査で、加齢黄斑変性症の罹患率調査は50歳以上の参加者6118人のうち、両目とも良好な眼底写真像が得られ、かつ糖尿病網膜症や黄斑前膜などの黄斑疾患を有しない5595人を対象として実施された。
前駆病変を含めたすべての病型が年齢とともにその有病率が増加した。男女別ではlate AMDやearly AMD、RPE色素異常は男性に多く、ドルーゼンの有病率には性差がなかった。その他の危険因子に関しては、喫煙がearly AMD、late AMDに発症に関係すると報告されている。
内訳
- Early AMD(ドルーゼンおよびRPE色素異常) 22.8%
- Late AMD(滲出型AMD or 萎縮型AMD) 0.58%
- ドルーゼン+ 39.4%
- Large drusen(≧125μm) 15.6%
加齢黄斑変性症(AMD)のリスク
加齢黄斑変性症(AMD)のリスクは加齢、喫煙(確実)である。
※日光曝露、肥満、高血圧などの関連も指摘されている。
※PCVは喫煙、高血圧、中心性漿液性網脈絡膜症の既往、遺伝的素因がリスク因子とされている。
加齢黄斑変性症(AMD)に関与する遺伝子
加齢黄斑変性症(AMD)は加齢や喫煙など環境因子や、複数の遺伝子の変異・多型が発症しやすさに影響を与えている。2005年にはCFHやARMS2/HTRA1などの遺伝子変異・多型がAMDの発症に大きく影響を与える感受性遺伝子であることが報告されている。これに関連して、片眼にAMDを発症した患者に対して、ARMS2/HTRA1の遺伝子配列を調べると、僚眼のAMD発症が予測できることはほぼ間違いないとされている。
加齢黄斑変性症(AMD)の症状
加齢黄斑変性症の自覚症状は病気の進行具合によって異なるが、初期は物が歪んで見える(歪視症)、中心が見えづらい(視力低下)、視界の真ん中がグレーになってかすむ(色覚異常)などの症状が多い。さらに進行すると、真ん中が真っ暗になって見えなくなる(中心暗点)。
加齢黄斑変性症(AMD)の診断基準
加齢黄斑変性症(AMD)の診断基準
- 50歳以上で、
- 中心窩を中心に半径3000μm以内の領域に以下の病変を認める。
- 前駆病変
・軟性ドルーゼン
・網膜色素上皮異常:網膜色素上皮の色素脱出、色素沈着、色素ムラ、直径1乳頭径大未満の漿液性網膜色素上皮剥離 - 滲出型AMD
主要所見:以下のうち1つ以上
・CNV+
・漿液性PED
・出血性PED
・線維性瘢痕随伴所見:以下の所見を伴うことが多い。
・滲出性変化:網膜下灰白色斑(網膜下フィブリン)、硬性白斑、網膜浮腫、漿液性網膜剥離
・網膜or網膜下出血 - 萎縮型AMD
脈絡膜血管が透見できる網膜色素上皮の境界鮮明な円形あるいは房状地図状萎縮(≧直径250μm)を伴う
除外規定:近視、炎症性疾患、変性疾患、外傷などによる病変を除外する。
地図状萎縮は40歳以上において有病率が0.16%であり、70歳以上に限ると0.29%であった。地域別にみると、東アジアよりも南アジア(インド、ネパール)で有病率が高く、男性の方が女性よりも地図状萎縮の頻度が高い傾向がみられた。
前駆病変
軟性ドルーゼンあるいは軟性ドルーゼンに付随するRPE異常のことを前駆病変とする。前駆病変には炎症と虚血が関連している。また、RPE内部にはリボフスチンが沈着し、そこで活性化する酸化ストレスなどによりRPE細胞に潜在性の障害が生じ、RPE細胞が炎症を惹起する液性因子を脈絡膜側に放出する。この液性因子が慢性の炎症を引き起こし、Bruch膜内部にドルーゼンが生じる。
Bruch膜が肥厚したり、脂肪が沈着すると、液性因子の拡散が阻害され、その場で網膜及び脈絡膜障害をきたす。軟性ドルーゼンが1個以上あれば前駆病変と診断され、軟性ドルーゼンが大型(drusenoid PED)、癒合性(confluent drusen)があれば滲出型AMDに移行する可能性が高くなる。RPEの異常は色素脱出(境界不明瞭で脈絡膜血管が透見できない程度の網膜色素上皮の萎縮)、色素沈着、色素ムラ、小型(1乳頭径未満)PEDをさす。
Bruch膜
RPEおよび脈絡膜血管から形成される約2μmの結合組織で正確には膜ではない。Bruch膜は脈絡網膜間のバリアの働きをしている。
Drusenの自然経過
小型ドルーゼン→大型ドルーゼン→色素沈着→ドルーゼンの消退・脱色素→軽度RPE異常 or 地図状萎縮となるが、多くは色素沈着から血管新生→CNVが出現するようになる。このCNVや地図状萎縮がある場合をlate AMDという。
前駆病変の画像所見
- 眼底検査:ドルーゼンは黄色小円形のRPEの隆起である。RPE異常は色素沈着、脱色素を示す。
- 光干渉断層計(OCT):PREのドーム状隆起としてみられ、内部は中等度反射である。前駆病変では滲出性変化は認めない。
- 蛍光眼底造影検査(FA):蛍光漏出はなく、後期に染色されるもの、されないものがある。
- IA:ドルーゼンに一致して低蛍光で、RPE異常は過蛍光、低蛍光のこともある。
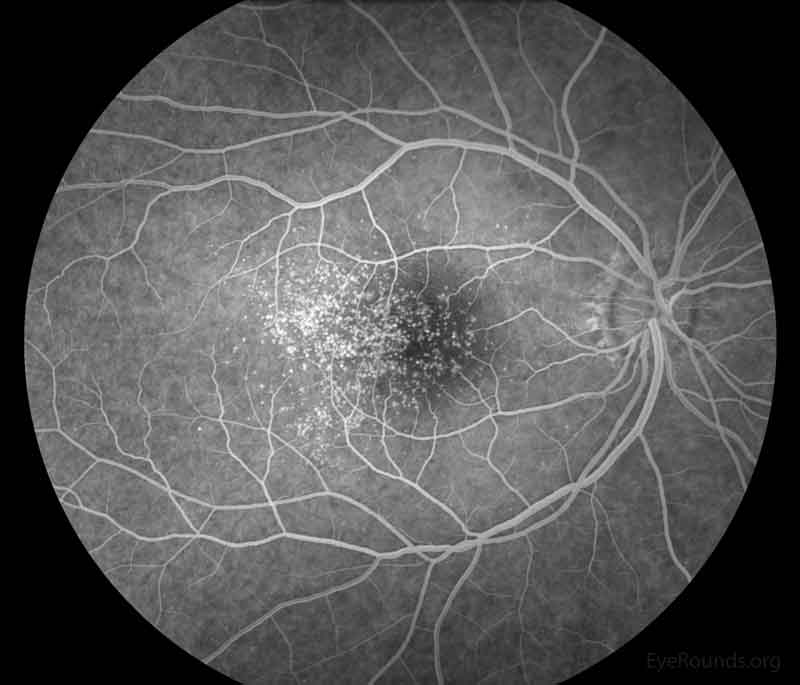
drusen の FA画像
Eye Rounds HPより引用
http://doctork1991.com/2020/10/18/fa-ia/
前駆病変の治療
治療方法はなく、黄斑に大型のドルーゼンがある、あるいは対側眼にすでに滲出型AMDがあれば大量のビタミンA、C、E、亜鉛からなるサプリメントを5年間服用すると滲出型AMDになりにくいとされる。
萎縮型加齢黄斑変性症(萎縮型AMD)とは
高齢者の黄斑部での加齢による網膜色素上皮、視細胞、脈絡膜毛細血管の萎縮性変化、Bruc膜の肥厚・変性に伴い視機能低下をきたす疾患である。滲出型AMDとともにAMDの進行期の病型として分類される。眼底所見として地図状萎縮(GA)の存在が必須である。
RPEと脈絡膜毛細血管の萎縮が進行し脈絡膜血管が透見できる状態で、RPEの境界鮮明な地図状萎縮としてみられ大きさは問わない。10-15%は経過観察中に脈絡膜新生血管を生じ、滲出性変化を認める場合は滲出型AMDとして治療を行う。
大小さまざまな多数のドルーゼンを伴うことが多い。典型例ではドルーゼンにおける色素沈着、ドルーゼンの消退、脱色素を経てGAへと進行する。軟性ドルーゼンを認める場合は硬性ドルーゼンを認めるものよりGAを発症する可能性が有意に高い。
※除外規定:続発性にCNVを伴う疾患、地図状萎縮との鑑別が必要な疾患とを除外する必要がある。
地図状萎縮
「眼底写真で境界鮮明な円形・楕円形で低色素・脱色素もしくはRPE欠損により、周囲網膜よりも鮮明に脈絡膜血管が透見できるもの」と定義されている。
萎縮型AMDの検査所見
光干渉断層計(OCT)
完全な網膜色素上皮および網膜外層の萎縮(cRORA)をGAの所見と定義されている。
フルオレセイン蛍光眼底造影検査(FA)、インドシアニングリーン蛍光造影検査(IA)
FAではwindow defectによる均一な過蛍光、IAでは低蛍光となる。
眼底自発蛍光(FAF)
萎縮部分ではリポフスチンを含む網膜色素上皮が消失しているため、境界明瞭な低蛍光を示し、辺縁は不規則な過蛍光を示すことが多い。
滲出型加齢黄斑変性症(滲出型AMD)とは
主要な所見はCNV、大型の漿液性PED、出血性PED、線維性瘢痕であり、少なくとも1つを満たせば確定となる。CNVは蛍光眼底造影検査(FAG)だけでなく、検眼鏡的に網膜下に白色病変または橙赤色病巣を認めれば確診となる。漿液性PEDはCNV伴わなくても1乳頭径以上であれば主要所見となる。出血性PEDと線維性瘢痕は滲出型AMDの特異度の高い所見である。滲出型AMDの随伴所見は網膜静脈閉塞症や網膜細動脈瘤などにも認めるため随伴所見となっている。
1.CNVによる滲出型AMD
CNVは脈絡膜からRPE下に向かって発育し、網膜下に達すると出血や滲出を生じる。共通する所見としては漿液性網膜剥離、嚢胞様黄斑浮腫(CME)、網膜下出血、硬性白斑である。漿液性PEDや出血性PEDはoccult CNVに発生することが多い。CNVを認める場合、典型AMDは35.3%、PCVが54.7%、RAPが4.5%程度とPCVが最多であると報告されている。
Gass分類
- Ⅰ型CNV:CNVがRPE下に存在する場合(15%)
- Ⅱ型CNV:CNVがRPE上に存在する場合(85%)
検眼鏡所見
Ⅰ型CNV
- RPEが不規則な橙赤色隆起病巣を示す。
- RPEが隆起(程度は様々)している。
- 隆起部の上皮が傷んでいれば萎縮や色素ムラがある。
Ⅱ型CNV
- RPE上に隆起した灰白色病巣がある。
- 漿液性網膜剥離がある。
- CNVの周囲にふちどり様に網膜下出血を伴う。
蛍光眼底造影検査(FA)
CNVからの漏出パターンによってClassic CNVおよびoccult CNVを分類する際に必要となる。特にⅡ型CNV検出に優れている。
Classic CNV
造影早期にはCNVに一致した境界鮮明な過蛍光を認め、後期には網膜下腔へ色素が漏出する。その結果、造影後期にはCNVの境界を越えて広がる強い過蛍光を示す。
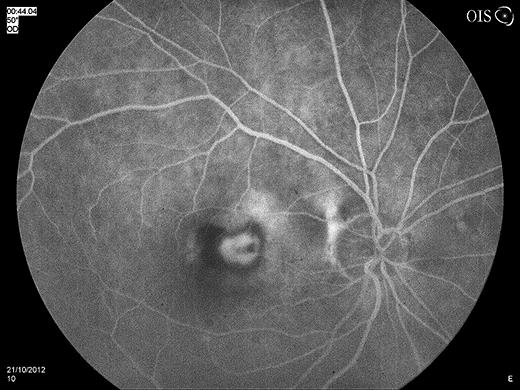
Occult CNV
Ⅰ型CNVではCNV上方の網膜色素上皮細胞中のメラニンがブロックし、造影早期の過蛍光は認めない。さらに、occult CNVには2種類ある。
- fibrovascular PED:造影1~2分後に点状過蛍光があり、造影後期で淡い蛍光漏出を示す。
- late leakage of undetermined source:造影開始2~5分には蛍光漏出部位ははっきりせず、造影後期で弱い蛍光漏出を認める。
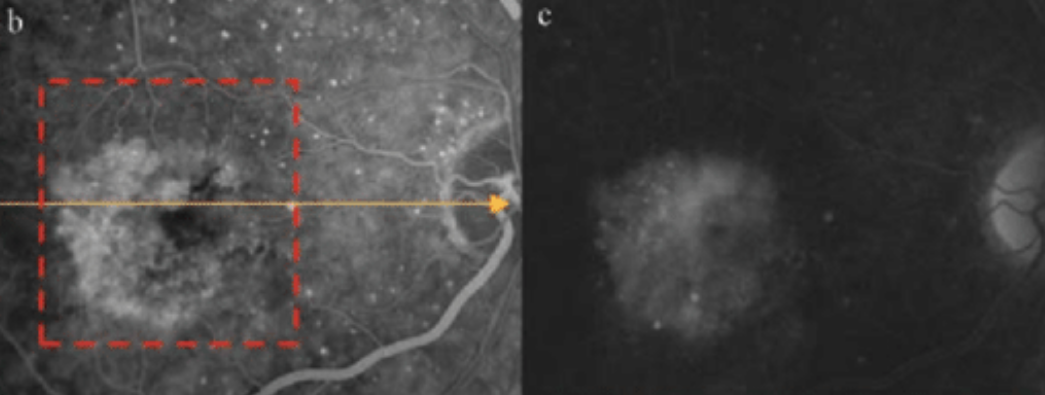
FA分類
中心窩CNVのあるAMDに対して光線力学療法(PDT)が行われるようになり、レーザー照射範囲を決めるためにFA分類が用いられる。このCNVの範囲の判断はclassic CNVでは造影早期の境界鮮明な過蛍光を、occult CNVでは後期の色素漏れ(10分程度)の範囲で判定する。
- Predominantly classic CNV:病変中classic CNV≧50%
- Minimally classic CNV:病変中classic CNV≦50%
- Occult with no classic CNV:病変中classic CNV=0%
インドシアニングリーン蛍光造影(IA)
網膜色素上皮を透過し、Ⅰ型CNVの検出に優れている。FAでoccult CNVならIAが有用である。ただ、classic CNVおよびoccult CNVとも典型例では網目状の異常血管網が造影早期に検出されることが多い。大量の出血や漿液性網膜色素上皮剥離がある場合のCNVの検出には有用である。
光干渉断層計(OCT)
Ⅰ型CNVは網膜上皮下なのでCNV自体は検出困難であり、網膜色素上皮を示す高反射層の突出や肥厚の状態から推測する。Ⅰ型CNVはdouble layer signを示すものと、RPEがドーム状に隆起した線維血管性色素上皮剥離に分けられ、後者は特に難治性とされる。網膜色素上皮下CNVでは網膜色素上皮は不規則に隆起する。網膜色素上皮下腔には中から低度の反射がある。Ⅱ型CNVではRPE上の高反射塊として検出できる。
Ⅰ型CNV
Research Gate HPより引用
Ⅱ型CNV
Research Gate HPより引用
2.滲出型加齢黄斑変性症(滲出型AMD)の診断
まずIAの所見でPCV、RAPを除外し、OCTあるいはFAの所見でoccult CNVかclassic CNVかに分類する。
ポリープ状脈絡膜血管症(PCV)とは
ポリープ状脈絡膜血管症(PCV)は滲出型AMDの特殊型として分類される疾患で、脈絡膜レベルの異常血管網と、その先端のポリープ状病巣からなる疾患である。漿液性PEDまたは出血性PEDを伴うことが多い。日本人の滲出型AMDのうち、54.7%がPCVであった報告された。診断にはIAが有用とされる。日本PCV研究会はポリープ状病巣に着目した診断基準を提唱している。
ポリープ状脈絡膜血管症(PCV)の診断基準
確実例(どちらかでOK)
- 眼底検査で橙赤色隆起病巣※を認める
- IAでポリープ状病巣※※を認める
不確実例(どちらかでOK)
- IAで異常血管網のみを認める
- 再発性の出血性PED、漿液性PEDを認める
※橙赤色隆起病巣は網膜色素上皮レベルの境界鮮明な充実性の隆起性病巣で、充実性で、漿液あるいは出血性PED特別できる
※※ポリープ状病巣はIAで瘤状、あるいはぶどうの房状の病巣である。早期に過蛍光で時間とともに大きくなり、ある時点から形や大きさは変わらない。
ポリープ状脈絡膜血管症(PCV)の分類
- PCVの位置による分類
・黄斑型:日本人に多いタイプで、Uyamaらの報告によればPCVの93%を占めるとされる。黄斑部に病変があるため歪視や視力低下などの自覚症状を生じる。
・視神経乳頭型:視神経乳頭あるいはその近傍に病変が存在する。 - IA所見による分類
1)狭義のPCV:狭義PCVの異常血管網はIAで周囲の脈絡膜動脈と同時に造影され、拡張、狭窄、蛇行など走行異常を示し、周囲の正常血管に連なることが確認できる。流入・流出血管は伴わない。
2)polypodial CNV:IAで流入・流出血管描出される。異常血管網は大型で、流入血管から分枝が多数、放射状に伸びる形で形成され、その辺縁にポリープ状病巣が描出される。IA後期にはplaqueを生じ、classic CNVを合併することおまる。
ポリープ状脈絡膜血管症(PCV)の検査
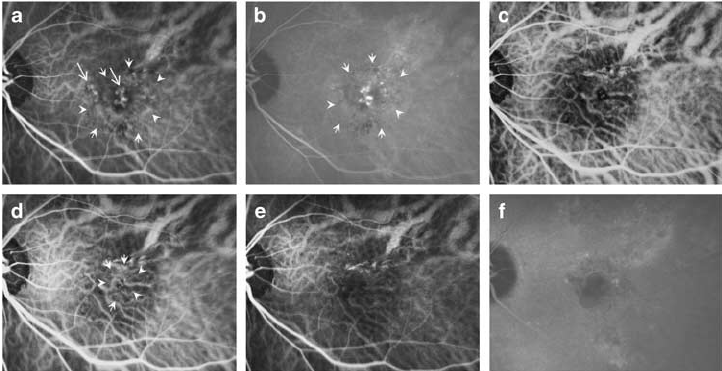
ポリープ状脈絡膜血管症(PCV)のFA
ポリープ状病巣に一致した部位は、造影の比較的早期に過蛍光を示す。後期の所見は様々で、window defect、組織染あるいは色素漏れを示す。ポリープ状病巣に接してRPEの萎縮を示すwindow defectを認める。
ポリープ状脈絡膜血管症(PCV)のIA
検眼鏡的に橙赤色隆起病巣に一致して、IAでもポリープ状病巣を認める。早期に過蛍光を示し、造影時間とともに大きくなり、ある時点から形は変わらない。後期には色素漏出をきたすことがある。また、輪状の過蛍光となることもある。
ポリープ状脈絡膜血管症(PCV)のOCT
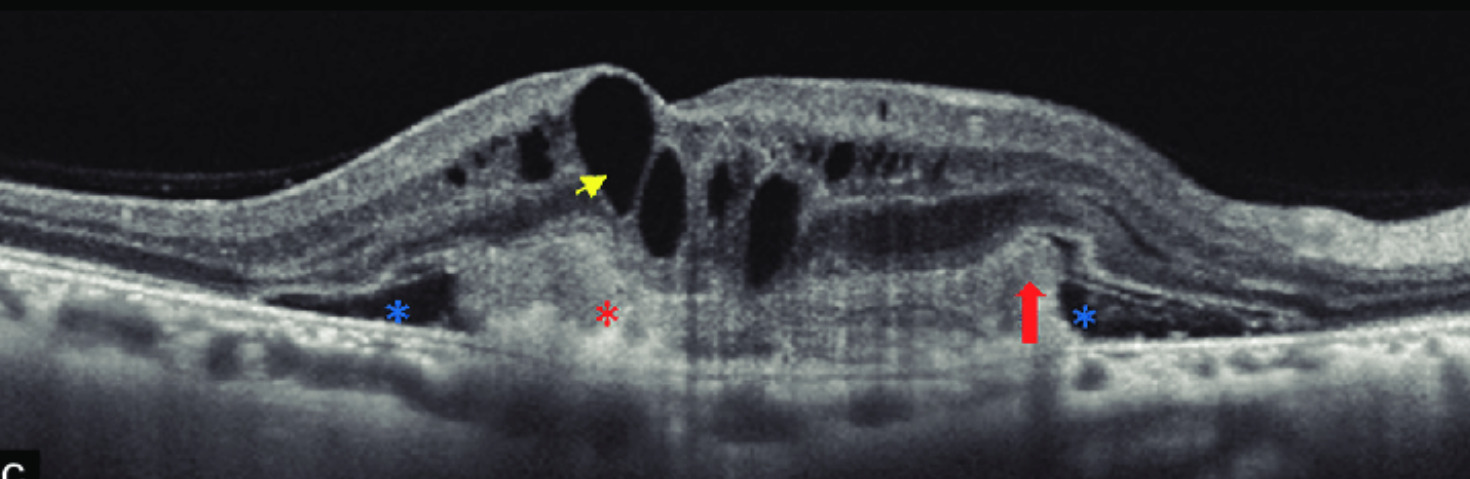
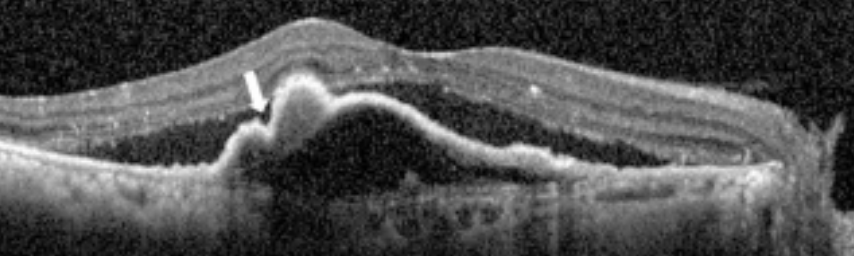
ポリープ状病巣は前方に突出するRPEの高反射帯として認め、漿液性PEDと類似している。漿液性PEDは突出の程度が急峻、表面凹凸不整がある点で異なる。異常血管網の範囲では、RPEを示す高反射が隆起し、下方にもう一層の高反射帯を認めることがある(double layer sign)。
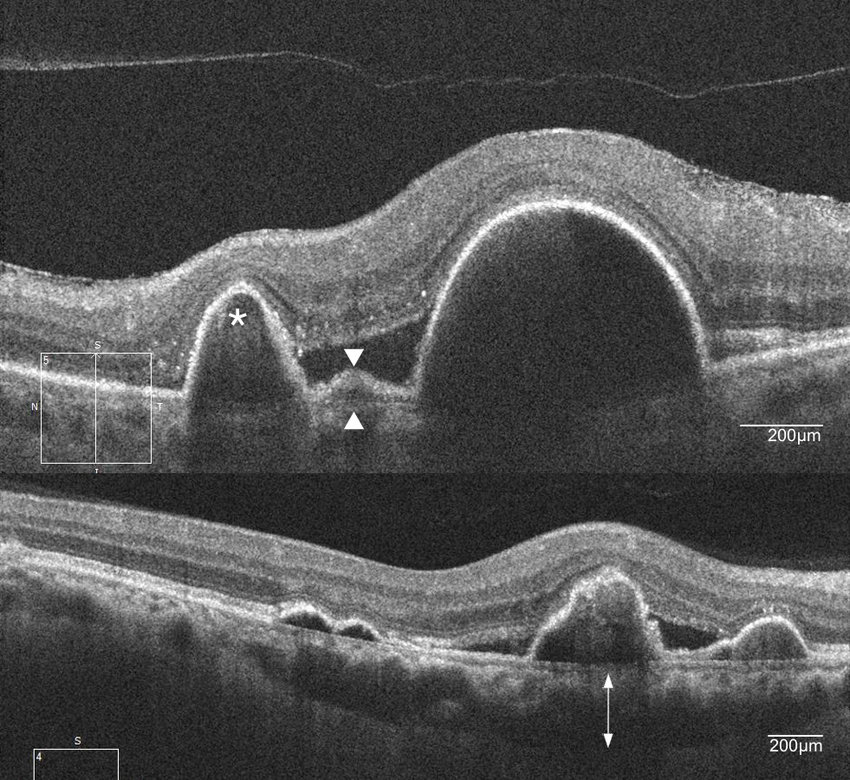
矢頭はdouble layer sign
Research Gate HPより引用
また、PEDのドーム状隆起の縁に小型PEDが連なるように描写されることがあり、これをtomographic notch in the PEDと呼び、CNVが周囲と癒着してRPEを牽引することでできるとされ、CNVを示唆する所見とされている。多くの症例でIAで同様の部位にポリープ状病巣が観察される。
ポリープ状脈絡膜血管症(PCV)のFAF
眼底自発蛍光(FAF)の蛍光物質はリボフスチンで、主にRPEに存在する。RPEに障害があると、リボフスチンが代謝されず蓄積する。RPEが軽度障害されるとFAFは過蛍光となるが、障害が強くなると蛍光は消失する。
ポリープ状脈絡膜血管症(PCV)の予後
PCVは予後良い例もあれば、悪い例もある。このように多様な経過をとるため、他の疾患と類似し、時には診断に非常に苦慮することがある。
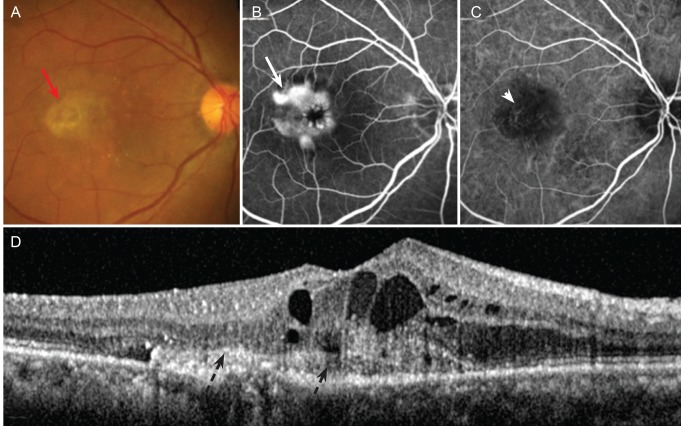
網膜血管腫状増殖(RAP)とは
加齢黄斑変性症(AMD)はCNVが起源だが、網膜血管腫状増殖(RAP)は網膜内新生血管(IRN;intraretinal neovascularization)が起源となる。黄斑部に多数の軟性ドルーゼンを認める。両眼性で高齢者(特に女性、白人に多い(欧米ではAMD全体の15~20%))に発症しやすい。さらに、RAPは下記の3病型に分けることができる。
- StageⅠ:網膜内新生血管(IRN)のみを認める。最も初期の変化で、黄斑部の網膜深層の毛細血管網から網膜内の血管増殖が発生する。IRNは周りの網膜血管を吻合し、網膜―網膜血管吻合(RRA;retinal-retinal anastomosis)を形成する。検眼鏡的に網膜浮腫と多発する網膜内出血を認めるが、多くは無症候性である。
- StageⅡ:IRNが網膜の視細胞層を越えて網膜下腔へ進展し、網膜下新生血管(SRN;subretinal neovasculaization)を形成する段階である。網膜浮腫、網膜内出血はStageⅠより増強する。SRNがRPEに達すると、ほぼ全例で漿液性PEDが発生する。
- StageⅢ:IRN+SRN+CNVを認める。CNVを伴い、これがRPE下に進展した新生血管と吻合し、網膜-脈絡膜血管吻合(RCA;retinal choroidal anastomosis)を形成する。
網膜血管腫状増殖(RAP)の診断
- 眼底所見:網膜内出血や網膜前出血など網膜表層に出血を認めることが多い。また、軟性ドルーゼンなども認めることが多い。
- IA:RRAがあれば診断確定である。造影後期で新生血管から旺盛な蛍光漏出(hot spot)があればRAPを示唆する。
※StageⅢでは網膜下新生血管と吻合するRPE下の小型のCNVとの吻合血管を認める時期にはPED下の小さなCNVはIAではRPEと、色素上皮下液のブロック効果のために検出されないこともある。 - FA:Occult with no classic CNVやMinimally classic CNVを示すことが多い。
- OCT:IRN、SRNは網膜外層の中~高反射塊(bump sign)として描出されることが多い。また、漿液性網膜剥離がみられることがある。SRNがさらに進展してRPEに達するとPEDが発生するが、このときIRN、SRN下のRPE高反射層は欠損を示すことが多い。また、強いCMEを認めることもある。
Pachychoroid Neovasculopathyとは
Pachychoroid Neovasculopathyは中心性漿液性脈絡網膜症(CSC)あるいはPachychoroid pigment epitheliopathy(PPE)に続発して生じたCNVを有する疾患である。2015年頃よりFreundらによって報告された疾患概念である。
下記全てを満たす場合にPachychoroid Neovasculopathyと定義する。
- CNVを少なくとも片眼に認める。
- Pachychoroidの特徴を有する。
・OCT、IAで脈絡膜血管拡張(Pachyvessel)
・眼底で脈絡膜血管の透見性低下
・IAで脈絡膜血管透過性亢進:IA後期においてリング状に過蛍光所見が拡大する所見を呈する。典型例では広範囲に複数箇所認める。中央にはpunctate hyperfluorescent spotという点状の過蛍光点を認めることが多い。 - 両眼にドルーゼンは存在しない、あるいは少量の硬性ドルーゼンのみ
※まだ定義は定まっていない。
※脈絡膜厚は年齢・眼軸長により個体差が大きい。
※Pachychoroid pigment epitheliopathy(PPE):CSCと同様の特徴を持つが、既往も含め漿液性網膜剥離を認めない症例とする。
※Pachychoroid の特徴を有する地図状萎縮を認める症例をPachychoroid geography atrophy(GA)という。
Pachychoroid Neovasculopathyのその他の特徴
- 平均年齢69歳だが、AMDより比較的若年で40代で発症する。
- 男性に多い。アジア人に多い。
- 前房水中のVEGF濃度が低値(比較はneovasculopathy AMD)である。
- 中心窩脈絡膜厚が厚い。
- type 1 CNVの特徴を有する。
- 眼底検査:脈絡膜紋理の減少、ドルーゼンがない(あっても少量の硬性ドルーゼン)
- 半数以上の症例でIAで脈絡膜透過性亢進所見、ポリープ状病巣、RPE異常を認める。それ以外にも、脈絡膜血管拡張、CNVなども認める。
- 比較的良好な視力で小さなCNVが多いが、バリエーションは様々である。
- 最終視力に関連する因子は初診時視力・黄斑下出血の有無が最も影響する。
- 20%に4乳頭径以上の黄斑下出血を認める。
- 大きい病変サイズ・ポリープ状病巣の有無が黄斑下出血の発生に影響する。
Pachychoroid neovasculopathyの治療
治療の報告は散見される程度にとどまる。2018年Matsumotoらの報告ではアフリベルセプト硝子体注射をTAEで行い、2019年Jungらの報告ではラニビズマブあるいはアフリベルセプト硝子体注射を3回毎月投与で改善効果があったとされる。

加齢黄斑変性症(AMD)の治療
加齢黄斑変性症(AMD)の予防
加齢黄斑変性症(AMD)の予防として禁煙指導など生活習慣の改善(運動、遮光、緑黄色野菜の定期摂取、地中海式ダイエット)を行う。
AREDSおよびAREDS2の報告で、AREDSでは抗酸化ビタミン+亜鉛摂取群が有意に後期AMDを予防し、AREDS2ではルテイン+ゼアキサンチン摂取群で有意に滲出型AMDの発症が抑制された。ルテインを少なくとも10㎎含む一方で、βカロテンは喫煙者では肺癌発症のリスクが高まるため避けるべきである。
黄斑に大型のドルーゼン、多数のドルーゼン、対側眼にすでに滲出型AMDを認める場合はサプリメントを定期摂取することが推奨される。萎縮型AMDの約10%はCNVを発症し、滲出型AMDとなることがあるためサプリメントが推奨されている。両眼に滲出型AMDがある時はサプリメント効果は不明である。
この成分に近いサプリメントを定期摂取する。
- ビタミンC(500㎎)
- ビタミンE(400IU)
- 亜鉛(25㎎)
- ルテイン(10㎎)
- ゼアキサンチン(2㎎)
- 銅(2mg)
加齢黄斑変性症が中心窩外にある場合
CNVあるいはPCVのポリープ状病巣が中心窩外にあれば網膜光凝固術を行うこともある。しかし、PCVでは滲出性のあるポリープ状病巣のみ、あるいは滲出性のあるポリープ状病巣と一部の異常血管網のみを光凝固する部分凝固と、全てのポリープ状病巣と異常血管網を含めた病変全体を凝固する全体凝固がある。部分凝固では異常血管網から新たに病巣ができ、再発を繰り返す恐れがある。
また、全体凝固では広範囲のため侵襲が大きいなど、網膜光凝固術だけでは満足のいく治療はできなかった。さらに、抗VEGF薬やPDTの台頭により、網膜光凝固術は中心窩外にあり、新生血管も比較的小さく凝固斑による暗点もあまり問題にならない症例など、一部の症例にのみ行われているのが実際である。
網膜光凝固術を行う場合、凝固した部位は暗点になり見えなくなること、一時的に出血や滲出性変化の増悪をきたすことがある旨は事前に説明しておく必要がある。また、網膜光凝固術は根治治療ではなく、再発するリスクはあることも併せて説明しておく必要がある。
網膜光凝固術の具体的なやり方
CNVに100μmののりしろを付けて囲むように中心窩から遠い部位から凝固を開始し、病変の中心に向かって堤防状にCNVを囲い(100μm0.1秒)、次いでCNVを覆うように凝固する(200μm0.2秒)。栄養血管を光凝固する際には、IAの初期画像を参考に、CNVへの流入血管を同定し、十分な強さで凝固する。
他にも黄色以上の波長のレーザー(出血部は赤色)でスポットサイズ200~300μm、出力150~250mW、凝固時間0.2~0.5秒で、CNV周囲に100μmのsafety marginを含んでCNV全体に中等度以上の光凝固を行うという方法もある。
光凝固術の合併症
上で少し触れたが詳細に示すと、
- 凝固斑の拡大
- 網膜・脈絡膜出血
- 滲出性変化増悪
- 網膜色素上皮裂孔
などの合併症がある。
※近視眼、加齢による脈絡膜萎縮があると凝固斑拡大は起こりやすい。
※PCVの症例や丈の高い色素上皮剥離がある場合は脈絡膜出血や網膜色素上皮裂孔をきたしやすい。
加齢黄斑変性症が中心窩下にある場合
CNVあるいはPCVで異常血管網やポリープ状病巣があればPDT、抗VEGF薬、あるいは両者併用療法を行う。
中心窩にポリープ状脈絡膜血管症(PCV)がある場合
- 視力≦0.5(or 0.7)⇒(PDTあるいは)VEGF阻害薬+PDT併用療法
- 視力≧0.6(or 0.8)⇒抗VEGF薬単独療法(こちらでも併用療法が行われていることが増えた)
を行う。ただし、脈絡膜血管透過性亢進(CVH)があるPCVではラニビズマブによる滲出抑制効果は弱く、併用療法による治療成績が良好であった。また、PCVは典型AMDや正常眼と比較して平均脈絡膜厚が厚いとされており、併用療法の視力予後は脈絡膜の厚い症例で良好であったと報告されている。一方で、脈絡膜の薄い症例に対する併用療法は、脈絡膜の更なる菲薄化を招き、黄斑萎縮のリスクになる恐れがあるため注意して行う必要がある。
PCVの抗VEGF薬とPDT併用療法の参考文献
1.EVERESTⅡ試験
PCV患者に対して、ラニビズマブ単独とラニビズマブ+PDT併用の治療効果を無作為前向きで比較検討した試験である。1年目、2年目のポリープ完全退縮率と視力改善ともに併用群の方が有意に高かった。
2.PLANET試験
PCV患者に対して、アフリベルセプト単独とアフリベルセプト+PDTによるレスキュー療法を比較検討した試験である。1、2年目ともにアフリベルセプト単独療法はレスキュー群に対して非劣性であった。また、PDTによるレスキューは約15%であった。
光線力学療法(PDT)
光線力学療法(PDT)は中心窩に病変を含んでも治療可能で、日本人では臨床研究で視力維持ができたという報告もある。
PDTの適応
現在、AMDの治療の中心は抗VEGF薬が中心となっているが、下記の場合は抗VEGF薬併用PDTが行われることがある。PDTはポリープ状病巣の閉塞率が高く、RAPにおいてRRAの閉塞率が高い。PDT単独の視力改善効果は乏しいが、抗VEGF薬がその効果を補うことが期待される。また、PDTの治療後に照射部位におけるVEGFの発現亢進とそれによる再発やPDT照射後の出血の出現を緩和する可能性がある。
- 抗VEGF薬単独療法で滲出病巣の寛解が得られにくい滲出性AMD
- 再発性・難治性PCV or RAP
- 最近の脳梗塞既往例
※PEDの中にCNVがあると成績が悪く、CNVあるいはPCVの栄養血管が太い場合、PCVでは病変が大きい場合には大出血を起こしやすい。
-320x180.jpg)
光線力学療法(PDT)後の視力
初回光線力学療法(PDT)施行後はFAを3か月毎に行い、色素漏れがあれば再度PDTを行う。報告によれば1年後、2年後ともPDT前の視力維持効果があるとされるが、視力の改善効果は少ないことが示されている。
一方、PCVだけを見ると2013年に未治療PCVに対するラニビズマブとPDTを比較した前向きスタディが日本から報告され、12か月においてPDT単独治療では視力維持効果であり、ラニビズマブでは有意な視力改善を認めた。PDTはPCVに対するポリープ状病巣閉塞率が高いものの、現段階でその適応は視力不良例(視力≦0.5)や難治例が良い適応と思われる。
光線力学療法(PDT)の合併症
PDTの合併症
- PDT後には網膜下出血や硝子体出血をきたし、急激な視力低下をきたすことがある(2005年に報告されたPDT術後出血スタディによれば、血管アーケードを超える重症出血例は3.7%、硝子体出血は1.0%)。
- 脈絡膜循環障害、脈絡膜厚の減少が出現しうる。
- 地図状萎縮(geographic atropy:GA)が進行、拡大しうる。
⇒副作用防止のためにレーザー照射時間短縮、ベルテボルフィンの投与量を半減、抗VEGF薬を併用するなどの工夫が行われる
PDT治療後の注意
治療後は光線過敏症の副作用を避けるため、薬物代謝に必要な24~48時間は屋内で過ごし、直射日光に曝露しないよう指導する。実際には多めに3~5日程度、外出をさけるように指導している施設が多いようである。
抗VEGF薬硝子体内注射
CNVの発育にはVEGFが関与し、眼内ではVEGF-Aが関与する。ラニビズマブ(ルセンティス®)、アフリベルセプト(アイリーア®)、ブロルシズマブ(ベオビュ®)が使用可能となっている。滲出型AMD、視力良好のPCVやRAPには抗VEGF薬単独療法が推奨されている。
RPEが安定していること、網膜外層が温存されていること、急性期であることのいずれかを満たしたfluidは抗VEGF薬の薬効が期待できる。
1.ペガプタニブ(マクジェン®)
2020年2月に販売を中止している。他のVEGF薬に比べて、治療効果が弱いとされるが、病的血管新生に関与するVEGF-A165を選択的に阻害する。ただし、ペガプタニブは導入期に視力改善効果が乏しく、滲出性変化の抑制効果も弱いため、小型の新生血管を有する症例や、何らかの全身性の血管障害をもつ例での使用、維持期での再発予防に適する薬剤と考えられている。
2.ベバシズマブ(アバスチン®)
もともと結腸がん・直腸がんへ使用が承認されているが、VEGF-Aの全アイソフォームに結合する抗体である。ただし、使用には各施設で倫理委員会の承認が必要となる。2005年にRosenfledらによりAMDのCNVに対して使用され、眼局所・全身の副作用もなく、網膜下浮腫の吸収、視力維持が得られたため、広く世界で使われるようになった。
2013年にイギリスで行われたIVAN studyでもベバシズマブとラニビズマブに同様な治療効果、全身性合併症においても相違がないことが確認されている。最近ではtreat and extendが行われている。安全性について眼局所では網膜色素上皮裂孔、地図状網脈絡膜萎縮、ぶどう膜炎、眼内炎、白内障など、ベバシズマブ投与による合併症と硝子体注射自体の合併症があると考えられる。
特に地図状網脈絡膜萎縮は22%発生しており、注意が必要な合併症である。全身性の問題では、動脈血栓塞栓症、高血圧症、消化管出血などが注目される。動脈血栓塞栓症の発生頻度は3~5%で、ラニビズマブと有意差はなかったとされる。
3.ラニビズマブ(ルセンティス®)
ラニビズマブはVEGFに対するマウスモノクローナル抗体(A4.6.1)のFabフラグメント(可変領域)を基本構造として作成された蛋白製剤であり、VEGF-Aの全てのアイソフォームを阻害する。分子量が小さいFabフラグメントとして設計されているため、網膜への浸透性が向上し、血中半減期が短く、全身循環から排出されやすい点が本製剤の特徴である。
日本および海外の報告によるとPredominantly classic CNV、Minimally classic CNV、Occult with no classic CNVでは0.5㎎の4週ごとの硝子体内投与で1年後の平均視力が改善する。ただし、ラニビズマブは全てのVEGF-Aを阻害するため、脳梗塞の既往があると再発率が高くなる可能性が報告されている。一方、PCVに対してポリープ状病巣は消失しにくく、異常血管網は残存し、出血、滲出の吸収には効果があるものの治療効果には限界がある。
ラニビズマブの投与方法
導入治療として0.5㎎を1か月ごとに計3回投与し、維持期には1か月ごとに経過観察し、視力低下、滲出性変化、新たな出血等で必要なら再投与(PRN :pro re nata)する。PrONTO Studyが行われ、PRNは毎月投与群と同等の視力改善効果が報告されている。他方で、患者ごとにドライな黄斑が維持できる期間を確認しながら投与間隔を延ばしていくtreat and extendも行われている。
実際には毎月治療計3回をした後、来院間隔を2週間ごと広げ、最大12週まで来院間隔を広げていき、また再発があった場合には2週間ごと、来院間隔を縮めていき最適な投与間隔を検索していく。
ラニビズマブの滲出性AMDでの効果
日本ではEXTEND-1 Studyが行われ、典型加齢黄斑変性症において12か月の段階で有意な視力改善が得られている。
ラニビズマブのPCVでの効果
2013年のLAPTOP Study(日本)においてラニビズマブ単独とPDTとの前向き比較試験で、12か月でラニビズマブ単独療法において有意な視力改善効果を認めた。また、PCVにおいては視力を問わず、ラニビズマブ単独療法において少なくとも12か月において、良好な治療効果が得られている。
さらに、Hikichiの後ろ向き研究でもラニビズマブ単独療法において2年の成績で有意な視力改善効果が得られている。しかし、ラニビズマブ単独療法では、ポリープ状病巣の閉塞効果が30~50%と弱く、滲出が残存する症例が多いことに注意が必要とされる。また、ポリープ状病巣の完全退縮率は20~30%であったが、アフリベルセプトでは40~50%であった。
ラニビズマブのRAPでの効果
RAPの新生血管は網膜内にあるため、ラニビズマブ単独療法で滲出性変化は速やかに消失することが多く、視力改善効果も良好である。しかし、RRAが閉塞しにくい例が多く、再発率は高い。再発が多ければPDTを併用することが推奨されている。PRN投与による長期的な有効性も示されている。
ラニビズマブの安全性
ラニビズマブ硝子体内投与で最大の問題点は眼内炎であるが、日本でのルセンティス発売後約2年間で1/3724(0.03%)と極めて低い頻度であった。また、全身性合併症として、高血圧や脳梗塞・心血管イベントが懸念されるが、血圧上昇や脳心血管イベントは脳梗塞の発症が3/3515(0.09%)、心血管イベントが1/3515(0.03%)、高血圧が1/3515(0.03%)と、脳梗塞はやや高い傾向にあった。
4.アフリベルセプト(アイリーア®)
ヒト型VEGF受容体1(VEGFR-1)と2(VEGFR-2)の細胞外ドメインの一部をヒト型IgG1のFc部分と融合させた遺伝子組換え融合タンパク質で、硝子体内投与を目的に開発された等浸透圧液剤である。VEGF-Aとの親和性はラニビズマブの80~140倍で、活性持続時間は約2.5倍長いと予測されている。
ラニビズマブ投与群と比較してアフリベルセプト2か月に1回投与群の2年目の平均投与回数が少なかったことは、改善した視力を保ちながら維持期の治療回数も減らせる可能性が示されている。統計学的な有意差はないが、アフリベルセプトは分子量が大きく、循環系に移行するとペガプタニブやラニビズマブより半減期が長いため、血栓・塞栓イベントはラニビズマブより若干多い結果になっている。このことはアフリベルセプトでも血栓・塞栓イベントの既往のある患者などには慎重投与を検討する必要があるかもしれない。
VIEW 1/2 study
AMD患者に対して、IVR毎月投与群に対してIVA2カ月毎投与群は非劣性であった。さらに、IVAはPCVにおいて良好な成績であった。
5.ブロルシズマブ(ベオビュ®)
分子量26kDaのVEGF-Aをターゲットとした一本鎖フラグメントである。分子量が小さいため、アフリベルセプトの10倍以上のモル濃度を眼内に投与することができる。
wet AMDに対するブロルシズマブの効果は、HAWK試験とHARRIER試験という大規模第Ⅲ相臨床試験で検証された。これら2つの試験では、1817例の患者がブロルシズマブ3㎎投与群、6mg投与群、アフリベルセプト2㎎投与群の3群に分けられた。従来通り、導入期の12週で3回の硝子体投与を行い、アフリベルセプト2㎎投与群は8週ごと、ブロルシズマブ投与群では8週あるいは12週ごとの硝子体投与を行った。
結果は投与開始から48週時点におけるブロルシズマブ投与群の最高矯正視力については、アフリベルセプト投与群と比較して統計学的有意差はなく、非劣性が示された。また、中心窩網膜厚と滲出性変化(網膜内液、網膜下液、色素上皮下液、疾患活動性など)についてはブロルシズマブ6㎎投与群はアフリベルセプト投与群と比較して優越性を示した。さらに、ブロルシズマブ6㎎投与群の55.6%(HAWK試験)と51.0%(HARRIER試験)のwet AMD患者が12週ごとの投与を維持できた。逆に、約半数では疾患活動性が出現し、投与間隔が8週毎とアフリベルセプトと同様の投与間隔となった。
ただし、副作用として他製剤と比べて眼内炎症(ブロルシズマブで4.7%、アフリベルセプトで0.6%)や網膜血管閉塞、網膜血管炎が多く、炎症所見については注意する必要がある。飛蚊症や視力低下など自覚症状は診断よりも先行しており、周辺部網膜を中心に硝子体混濁、細動脈の狭細化や閉塞、白鞘化血管、軟性白斑や網膜出血、視神経乳頭腫脹などを認めないかを注意して経過観察する必要がある。
ブロルシズマブ投与後1-2週間後に起こることが多いが、最後の注射投与後3~63日後に起こりうるため眼内炎との鑑別が重要になる。また、網膜血管炎や血管閉塞になると不可逆的な視力低下をきたしうるため、炎症の程度に応じて、ステロイド点眼やトリアムシノロンテノン嚢下注射(STTA)を行う必要がある。
6.Abicipar pegol
Abicipar pegolはdesigned ankyrin repeat proteins(DARPins)という新規抗VEGF製剤である。現存する抗VEGF製剤が抗体製剤あるいは抗体フラグメントであるのに対して、Abicipar pegolはタンパク質製剤である。分子量が小さく、組織浸透性が高く、安全性も高いため薬理効果が持続すると期待されている。
本剤とラニビズマブとの比較試験であるREACH試験において、非劣性が示されたが、ラニビズマブ投与群では生じていない眼炎症所見がAbicipar pegol投与群の10.4%で生じたと報告されている。現在、SEQUOIA試験とCEDAR試験という第Ⅲ相試験の結果も公開されており、ブロルシズマブと同様、投与回数軽減の可能性が期待されている。
7.Faricimab
FaricimabはVEGF-Aとangiopoietin-2に対するバイスペシフィック抗体製剤である。AVENUE試験とSTAIRWAY試験というFaricimabを用いた第Ⅱ相試験が行われ、ラニビズマブと比較して投与回数軽減が期待される薬剤である。
TENAYA試験では、ファリシマブ群がアフリベルセプト群に対してベースラインからの視力の変化量は非劣性であった。しかし、投与間隔は4ヶ月おきで維持できた症例は45.7%、3カ月以上で維持できた症例が79.7%であり、ファリシマブは投与間隔を延長できる可能性がある。また、合併症に関してはアフリベルセプト群と大きな差はなかった。ただし、TENAYA試験にはアジア人が約1割で、本邦に多いPCVの症例登録は少ないことは留意する必要がある。
Port Delivery System(PDS)
PDSはVEGF投与回数を減らすためのドラッグデリバリーシステムで、強膜に薬剤のリザーバーを留置し、同部に薬剤を反復して再注入できるという方式を採用している。第Ⅱ相試験(LADDER試験)では179例のwet AMDに対してPDS留置が行われ、ラニビズマブ100㎎/ml注入群では約80%の患者が61カ月以上再注入を行うことなく、視力維持が可能となった。現在、第Ⅲ相試験(Archway試験)が進行中である。
VIEW試験の事後解析では、網膜内浮腫(IRC)はベースライン時および最終視力不良と関連していた。しかし一方で、SRFの残存は視力に大きな影響を及ぼしていなかった。その他、いくつかの検討から、IRFとSRFは消退させ、抗VEGF治療でも残存するSRFはある程度許容しても視力への影響は少ない可能性があると考えられる⑾。
PDT併用の抗VEGF薬
各疾患における抗VEGF薬単独療法の課題は下記の通りである。
- 典型AMD:ノンレスポンダー、タキフィラシー(繰り返しの治療後に効果が減弱する)。
- PCV:再発、ノンレスポンダー例がある。ポリープ状病巣退縮が限定的である。
- RAP:再発例が多く、抗VEGF薬の投与回数が増えてしまう。
このような課題があること、PDT単独療法後に網膜下出血などの副反応を抗VEGF薬により抑制できることが報告されてから、PDTは抗VEGF薬を併用することが一般的になっている。
EVEREST Ⅱ study
12か月時点で、PDT単独療法は9.5文字の視力悪化、IVR単独療法は5.1文字の視力改善、IVRとPDT併用療法は8.3文字の視力改善効果があった。
また、抗VEGF薬とPDT併用療法では、抗VEGF薬の抗血管新生作用や透過性亢進作用に加え、PDTには血管閉塞作用があり相乗効果が期待できる。さらに、PCVのポリープ状病巣閉塞率は高く、RAPのRRAの閉塞率が高くなるという報告もある。なお、抗VEGF薬投与時期は薬剤により異なるが、ラニビズマブはPDTの7日前より2日前の方が治療効果が高かったという報告があるため、その報告に準じて行う。
網膜血管腫状増殖(RAP)の治療
抗VEGF薬単独療法では滲出を一度抑制できても中止すると再発しやすい。治療回数が少なくすむPDT-VEGF阻害薬併用療法が推奨されている。しかし、視力良好眼ではVEGF阻害薬単独療法も考慮されることに加え、RAPの疾患概念の普及からそのような例が増えており、VEGF阻害薬単独療法が行われることが多くなっている。
また、抗VEGF薬併用PDTあるいはトリアムシノロンアセトニドも併用するトリプル療法が選択される場合もある。治療後は網脈絡膜の地図状萎縮や、網膜色素上皮裂孔などの合併症にも注意を要する。
萎縮型加齢黄斑変性症(萎縮型AMD)の治療
萎縮型加齢黄斑変性症(萎縮型AMD)の治療方法はないが、進行予防方法は開発されつつある。AREDS formulaで効果あるサプリメントとして、ビタミンC(500㎎)、ビタミンE(400IU)、ベータカロチン(15㎎)、亜鉛(80㎎)を毎日摂取することで萎縮型AMDの進行が予防できるかもしれないと報告された。
さらに、2006年に開始されたARDES2 Studyではルテイン、ゼアキサンチンによるLate AMDへの進行予防効果も確認された。また、亜鉛量の摂取を25㎎にして、ベータカロチンを摂取しなくても同様の結果が得られたため、下記6種類へと変更された。
- ビタミンC(500㎎)
- ビタミンE(400IU)
- 亜鉛(25㎎)
- ルテイン(10㎎)
- ゼアキサンチン(2㎎)
- 銅(2mg)
海外では、補体C3阻害薬であるpegcetacoplanの第Ⅱ相臨床試験が進行中であり、GAの進行抑制効果が示されている。
黄斑下血腫(SMH)を伴う症例に対する治療
SMHは突然の著明な視力低下をきたすが、原因疾患の有無によっては自覚しない場合もある。眼底検査あるいはOCTを用いて診断を行う。蛍光眼底造影検査を行うと、血管腫は過蛍光だが、血腫は低蛍光となるため鑑別は可能である。
治療方針を考える上で重要な情報
- SMHの原因疾患(AMD、網膜細動脈瘤、外傷、糖尿病網膜症)
- 全身既往歴(高血圧、循環器疾患)、抗凝固薬の内服の有無:抗凝固薬、抗血小板薬内服で出血するリスクは4倍で、ワーファリンによって大量出血を来すリスクは12倍とされる。
- SMHが生じてからの期間:視細胞障害は24時間以内に始まり、出血後2週間で不可逆的になる。
- 出血量、眼圧上昇の有無
SMHの治療適応基準
- できるだけ早期から1か月以内
- 出血量が2視神経乳頭径を超える、脈絡膜紋理が透見できない程度の厚さの出血、器質化した出血が出血全体の半分以下なら行う。
※適応外基準は巨大網膜下血腫を伴うSMHなど
中心窩にかかる出血が少量で、視力が比較的良好であればアドナ錠とトランサミンカプセルで経過観察をする。あるいは、滲出液を伴っていればVEGF阻害薬を投与する。また、硝子体手術が行われることがある。
- SMHを除去:黄斑下から吸引除去する。あるいは、t-PAを用いて凝血塊を溶解し、吸引除去する。
- SMHを黄斑外へ移動させる:膨張性ガスの硝子体内注入に加え、t-PA硝子体内投与を行う。あるいは、硝子体切除に加え、tPA網膜下投与+ガスタンポナーデ:空気網膜下注入+抗VEGF薬網膜下投与などが行われる。
加齢黄斑変性症(AMD)の予後
萎縮型加齢黄斑変性症(萎縮型AMD)は進行が緩慢であるが、地図状萎縮が中心窩に及べば視力は0.1以下となりうる。また、滲出型AMDはVEGF阻害薬療法により視力予後は改善してきてはいるが、放置すると約9割が0.1以下の視力になるとされている。
参考文献
- 日本眼科医会HP(知っておきたい加齢黄斑変性―治療と予防―)
- 眼科学第2版
- 網膜硝子体case20study
- 黄斑疾患診療AtoZ
- クローズアップ網膜診療
- 今日の眼疾患治療指針第3版
- 第74回日本臨床眼科学会シンポジウム2黄斑手術のパラダイムシフト、シンポジウムシンポジウム4網膜疾患診断法のパラダイムシフトと実臨床の変化
- あたらしい眼科37(3):251~260,2020
- あたらしい眼科Vol.37,No.2,2020
- あたらしい眼科Vol.37,No.12,2020
- Ursula Schmidt-Erfurth et al.Prog Retin Eye Res. 2016 Jan;50:1-24.
- Retinal precursors and the development of geographic atrophy in age-related macular degeneration
- Consensus Definition for Atrophy Associated with Age-Related Macular Degeneration on OCT: Classification of Atrophy Report 3
- Complement C3 Inhibitor Pegcetacoplan for Geographic Atrophy Secondary to Age-Related Macular Degeneration: A Randomized Phase 2 Trial
- The five-year incidence and progression of age-related maculopathy: the Beaver Dam Eye Study
- Pachychoroid pigment epitheliopathy
- Efficacy, durability, and safety of intravitreal faricimab up to every 16 weeks for neovascular age-related macular degeneration (TENAYA and LUCERNE): two randomised, double-masked, phase 3, non-inferiority trials
- Prevalence and Pattern of Geographic Atrophy in Asia: The Asian Eye Epidemiology Consortium
関連記事








